Мицеллообразование В Растворах Поверхностно-Активных Веществ.
- Русанов А.и. Мицеллообразование В Растворах Поверхностно-активных Веществ
- Мицеллообразование В Растворах Поверхностно-активных Веществ
СПЕЦИАЛЬНЫЙ ФИЗИЧЕСКИЙ ПРАКТИКУМ «ОПРЕДЕЛЕНИЕ ПАРАМЕТРОВ МОЛЕКУЛЯРНЫХ БИОСИСТЕМ» Специальный физический практикум «Определение параметров молекулярных биосистем» МИЦЕЛЛООБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ Цель: Изучить свойства ПАВ и найти ККМ ионогенного ПАВ методом люминесцентной спектроскопии. БЕЗЫЗЛУЧАТЕЛЬНЫЙ ПЕРЕНОС ЭНЕРГИИ ЭЛЕКТРОННОГО ВОЗБУЖДЕНИЯ В РАСТВОРЕ ОБРАТНЫХ МИЦЕЛЛ Цель: наблюдать изменение скорости переноса при различных гидродинамических радиусах мицеллы ВЛИЯНИЕ НЕКОТОРЫХ ГИДРОФОБНЫХ ЛИГАНДОВ НА СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ ГЕМОГЛОБИНА Цель: наблюдать конформационные изменения, приводящие к образованию белковых агрегатов, которые более интенсивно рассеивают свет. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА ОПТИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ ОКСИГЕМОГЛОБИНА Цель:Изучить оптические свойства растворов оксигемоглобина модифицированного воздействием различных температур. ОСМОТИЧЕСКАЯ УСТОЙЧИВОСТЬ ЭРИТРОЦИТОВ Цель: Изучить механизмы изменения проницаемости биологических мембран и найти осмотическую устойчивость и хрупкость эритроцитов ОПРЕДЕЛЕНИЕ РАЗМЕРОВ ЭРИТРОЦИТОВ Цель: Изучить дифракцию лазерного излучения на круглом диске.
Определить размер эритроцита крови. Лабораторная работа 1 МИЦЕЛЛООБРАЗОВАНИЕ В ВОДНЫХ РАСТВОРАХ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ Цель: Изучение свойств ионогенных ПАВ и нахождение ККМ методом люминесцентной спектроскопии. Общая характеристика поверхностно-активных веществ и явления мицеллообразования Энергетическое состояние молекул (или других частиц) жидкости в объемной фазе и на границе раздела фаз неэквивалентно. Внутри фазы частица со всех сторон окружена равновероятно по химической природе другими частицами, в чистой жидкости, например, себе подобными частицами.
«Поверхностно-активные вещества и полимеры в водных растворах» — читать онлайн бесплатно. На основе концепции мицелл как двумерно жидких и одномерно твердых объектов.
Силы межмолекулярных взаимодействий, одинаково действующих во всех направлениях, дают суммарную силу F 2 = 0 (рис 1). На границе раздела фаз «жидкость-воздух» или «жидкость - насыщенный пар» силы межмолекулярных взаимодействий частиц с молекулами газовой фазы и с молекулами со стороны объёма жидкой фазы не равны.
Русанов А.и. Мицеллообразование В Растворах Поверхностно-активных Веществ
В этом случае на частицу в поверхностном слое действует суммарная сила межмолекулярных взаимодействий F 1, направленная по нормали к поверхности вглубь объемной фазы (рис.1). В результате этого явления молекулы поверхностного слоя «втягиваются» внутрь жидкости, уменьшая площадь поверхности. При этом число частиц в единице объёма в приповерхностном слое может быть иным по сравнению с их числом в единичном объёме внутри фазы. Например, плотность воды в поверхностном монослое ниже плотности воды на 15%, для других жидкостей это понижение составляет 3-7%. Если жидкость представляет собою раствор, то концентрация растворённого вещества в поверхностном слое также может отличаться от его объёмной концентрации. Изменение концентрации вещества в поверхностном слое по сравнению с объёмной называется адсорбцией.
Адсорбция может быть положительной и отрицательной в зависимости от свойств растворенного вещества и растворителя. Например, неорганические кислоты, соли, сильные основания не только хорошо растворяются в воде, но и подвергаются электролитической диссоциации, что является следствием сильных межмолекулярных взаимодействий растворённого вещества и растворителя. Такие вещества проявляют отрицательную адсорбцию – их концентрация в поверхностном слое ниже, чем в объёме.
Понижение плотности чистой жидкости в поверхностном слое есть следствие отрицательной автоадсорбции. Существует обширный круг соединений, молекулярное строение которых является дифильным (их называют также амфифильными ). Это вещества, состоящие из функциональных частей разной природы - неполярного углеводородного фрагмента (радикалы R) и какой-либо полярной группы. Полярными могут являться группы СООН, СОО -, ОН -, сульфатная (-OSO 3 -), сульфонатная (-SO 3 -), группы, содержащие азот (-NН 2 и другие). В отношении воды полярный фрагмент амфифильного вещества является гидрофильным (любящим воду), а неполярный – гидрофобным.
Из-за особенности структуры такие вещества в воде растворяются ограниченно и в растворе обладают способностью концентрироваться в поверхностном слое, для них характерна положительная адсорбция, а сами они называются поверхностно-активными веществами (ПАВ). Чтобы подчеркнуть структурную особенность ПАВ, их принято схематично обозначать следующим образом: Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии погружения гидрофильных групп в водную фазу, а гидрофобных углеводородных цепей - в воздух или менее полярную фазу. При малой концентрации адсорбированных молекул в поверхностном слое тепловое движение нарушает их ориентацию, и молекулы в основном лежат на поверхности. Повышение концентрации ПАВ и насыщение адсорбционного слоя приводит к вертикальной ориентации углеводородных групп и образованию «молекулярного частокола» (рис.2). В этом состоянии площадь, занимаемая молекулой, определяется лишь площадью полярной группы, общей для всех членов гомологического ряда.
Для поверхностно-активных веществ с числом углеродных атомов в неполярной группе молекулы от двенадцати и выше наряду с положительной адсорбцией при концентрациях, близких к тем, когда происходит адсорбционное насыщение поверхностного слоя, в объёмной фазе образуются ассоциаты молекул ПАВ. Эти ассоциаты называют мицеллами, а само явление - мицеллообразованием. Ассоциаты ПАВ, образованные в водной среде, называют прямыми мицеллами, а в масляной - обратными. При формировании прямых мицелл углеводородные цепи молекул ПАВ объединяются в компактное углеводородное ядро. Полярные группы обращены в сторону водной фазы и образуют гидрофильную оболочку ( рис.3).
Число молекул в мицелле, m, называют числом агрегации. Оно может иметь значения от 20 до 100 и более. Равновесие между мицеллами, содержащими m молекул ПАВ, и раствором ПАВ молекулярной дисперсии можно описать подобно химической реакции с константой равновесия К. MПАВ (ПАВ) m, К = (ПАВ) m / ПАВ m. (1) Образование мицелл обратимо, так как они распадаются при разбавлении мицеллярных растворов на молекулы или ионы диссоциируемого ПАВ.
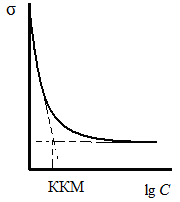
Концентрация, при которой мицеллы начинают образовываться, называют критической концентрацией мицеллообразования. Сферические мицеллы характеризуются узким распределением частиц по размерам. При увеличении концентрации ПАВ происходит переход мицеллы из одной формы в другую (цилиндрическую, дискообразную и т.д.). Эффективность моющего действия при стирке сильно зависит от наличия мицелл в растворе. Образованию мицелл способствует понижение температуры, увеличение молекулярной массы и концентрации ПАВ, наличие в растворе электролитов.
При определенной концентрации моющая способность растворов достигает максимума; дальнейшее увеличение концентрации ПАВ не приводит к увеличению моющей способности раствора. Ключ на power archiver. Уменьшение концентрации ПАВ в растворе также снижает моющую способность. Следовательно, по ККМ можно определять максимальное количество ПАВ, необходимое для наиболее эффективного моющего воздействия CMC. Так, при домашней стирке и в прачечных оптимальные концентрации моющих веществ составляют: для домашней стирки хлопчатобумажных тканей -2-3 г/л, в прачечных -1-2 г/л; для стирки шерстяных и шелковых тканей - 0,7- 2,5 г/л. К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами. Например, мицеллы додецилсульфата в воде. Мицеллы могут существовать в состояниях с различными равновесными структурами и в различных внешних формах, устойчивых при различных концентрациях ПАВ в мицеллярном растворе.
Мицеллообразование В Растворах Поверхностно-активных Веществ
Такая способность мицелл называется полиморфизмом мицелл. Термодинамические факторы мицеллообразования Рассмотрим более подробно причины, вызывающие самопроизвольную агрегацию молекул ПАВ в мицеллярные структуры. С точки зрения термодинамики движущей силой мицеллообразования является увеличение энтропии системы в целом (термодинамическая система включает растворитель и растворенное вещество). Основным фактором, приводящим к стабилизации мицелл, являются гидрофобные взаимодействия.
Под их действием система принимает такую структурную организацию, при которой сводятся к минимуму контакты между неполярными участками ПАВ и водой. Эти силы имеют в основном энтропийную природу и связаны с ограничениями, налагаемыми на упаковку молекул воды вокруг неполярных фрагментов. Рассмотрим это более подробно.
Структура чистой воды стабилизирована, прежде всего, водородными связями. Когда какой-либо ион, например Cl -, попадает в воду, происходит его сольватация, при этом молекулы воды образуют вокруг него гидратную оболочку. С точки зрения энтропии любое упорядочение молекул невыгодно, но этот фактор с избытком компенсируется сильными электростатическими взаимодействиями между ионом и молекулой воды. Поэтому изменение энергии Гиббса в процессе растворения соли в воде отрицательно. Когда в воде растворяется неполярное вещество, структура воды вокруг каждой молекулы также нарушается. Молекулы воды стремятся ориентироваться таким образом, чтобы сохранились межмолекулярные водородные связи. Те молекулы воды, которые непосредственно контактируют с молекулами растворенного неполярного вещества, соседствуют с меньшим числом себе подобных молекул, и в системе возникают значительные структурные напряжения.
При этом в данном случае компенсирующие электростатические взаимодействия отсутствуют. Невыгодные взаимодействия между неполярным растворяемым веществом и водой – это и есть те гидрофобные взаимодействия, под действием которых неполярные вещества стремятся свести к минимуму контакты с водой. Рассмотрим теперь, что произойдет при растворении в воде дифильной молекулы ПАВ. Под влиянием гидрофобного эффекта углеводородная часть молекулы ПАВ выталкивается из воды, чтобы насколько возможно избежать с ней контакта, и в результате образуются мицеллы (рис.3). Удаление из воды углеводородных цепей дифильных ПАВ в мицеллы снижает структурные напряжения в воде. Организация углеводородной части мицеллы сопровождается уменьшением энтропии, но изменение структуры воды связано с увеличением энтропии, в результате чего энтропия системы в целом увеличивается. Следует отметить, что способностью к мицеллообразованию обладают не все дифильные ПАВ.

Это явление зависит от двух факторов. Один из них − длина гидрофобной части молекулы. Поскольку гидрофобность пропорциональна площади поверхности контакта между водой и неполярным фрагментом, то чем длиннее углеводородная цепь ПАВ, тем значительнее нарушения структуры воды из-за увеличения площади контакта, тем больше склонность ПАВ к мицеллообразованию. С другой стороны, для образования мицеллярных систем ПАВ существенную роль играет способность полярных групп экранировать углеводородное ядро от контакта с водой. Эта способность определяется собственными размерами полярных групп и их характером взаимодействия с растворителем, в частности гидратируемостью. Такие полярные группы, как -СОО -, -SO 3 -, -OSO 3 -, (R) 4 N +, хорошо гидратируются и обладают большой экранирующей способностью. А, дифильные вещества с одной небольшой полярной группой, например, спирты жирного ряда, не способны к мицеллообразованию, даже при наличии длинной углеводородной цепи.
Другими словами, способностью к мицеллообразованию обладают лишь те дифильные вещества, которые имеют оптимальные соотношения между гидрофильной и гидрофобной частями молекулы. В научной литературе это называют гидрофильно-липофильным балансом (ГЛБ).
По природе гидрофильной группы дифильные вещества различают на ионогенные ПАВ, диссоциирующие в водных растворах с образованием ионов, и неионогенные, то есть не склонные к диссоциации.